5月27日,北京大學化學與分子工程學院、前沿交叉學科研究院生命科學聯合中心陳鵬教授課題組和王初教授課題組的合作成果以“Machine-learning-assisted universal protein activation in living mice”為題在《細胞》(Cell)雜志在線發表。
兩個課題組通過持續的深入合作,開發了融合“機器學習與生物正交剪切反應”的蛋白質活體激活技術,實現了“鄰近脫籠”策略從活細胞向活體動物的突破。
該工作通過機器學習與生物正交剪切反應融合驅動,獲得了一種創新的蛋白質原位激活平臺技術CAGE-Proxvivo,能夠在活體動物中瞬時激活目標蛋白質的功能,并精確調節蛋白-蛋白相互作用。此外,CAGE-Proxvivo還可以調節細胞表型,誘導腫瘤細胞發生焦亡,增強抗腫瘤免疫響應。
CAGE-Proxvivo技術使得生物正交剪切反應邁入了“任意蛋白+活體應用”的新時代,相當于找到了一把“萬能鑰匙”,可以隨心所欲地調控蛋白質的活性。這標志著活體化學反應發展的重要突破,不僅為動態生物學過程的原位研究提供了強大工具,也為按需式精準治療開辟了新的途徑。

論文截圖
什么是生物正交反應?
生物正交反應是指可以在生物體系中進行且不與內源生命過程相互干擾的化學反應。這類反應的發展,不僅拓展了傳統有機化學反應的生物學應用邊界,也將合成化學的邏輯引入生命系統研究,革新了生命過程的分子解析與精準調控方式,為揭示復雜生理、病理機制提供了全新視角。
以“點擊化學”為代表的生物正交反應因為有效解決了復雜生命體系中特定生物分子的原位標記與示蹤等關鍵科學難題,獲得了2022年度諾貝爾化學獎,但這一以“偶聯”為核心的化學反應模式仍存在局限,難以實現對生物大分子功能的調控和解析。
陳鵬課題組長期致力于“活細胞化學反應”的開發與應用,在國際上率先提出并發展了基于“斷鍵”化學的生物正交反應——生物正交剪切反應(Bioorthogonal Cleavage Reaction, Nat. Chem. 2014, 6, 352.)。與傳統的“連接”反應不同,這種剪切反應通過化學鍵的斷裂,實現對靶標分子中掩蔽基團的時空可控釋放。
該策略突破了利用化學反應調控生物大分子功能的技術瓶頸,實現了蛋白質在活細胞等環境中的精準“脫籠”和激活,使得生命過程和分子互作在特定的時間和空間內被精確開啟,為活細胞的功能研究開辟了新的途徑。
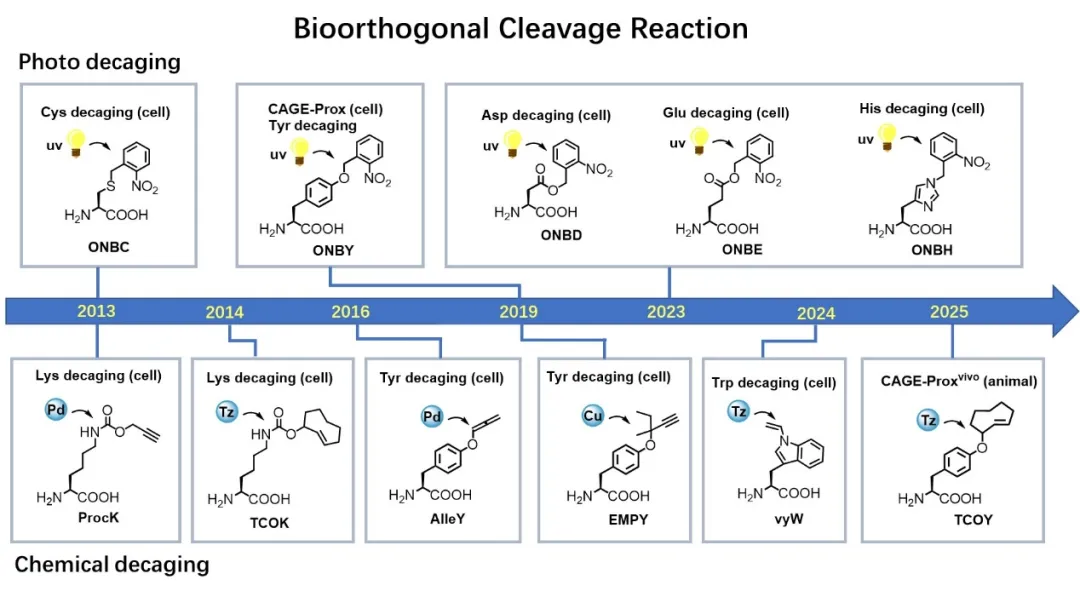
化學(光)脫籠生物正交剪切反應的發展歷程
什么是“脫籠”?
“化學脫籠”策略是一類適用性廣、干擾度低的蛋白質激活方法,通過對酶的關鍵催化殘基的保護和脫保護,可以實現對其活性的“關-開”調控。陳鵬課題組先后在賴氨酸、酪氨酸等活性氨基酸側鏈上實現了生物正交斷鍵反應和脫籠,在活細胞及活體動物內實現了蛋白激酶等多種蛋白質的特異激活。
然而,受限于可以進行脫籠反應的非天然氨基酸類型,上述基于催化殘基的“直接脫籠“策略只能在某些特定蛋白家族中應用。如何進一步發展廣泛適用于不同類型蛋白家族的原位激活方法,在活體環境內研究蛋白質動態功能變化,是眾多化學生物學研究者力圖實現的重要目標。
2019年,陳鵬課題組與王初課題組合作,利用紫外光控的生物正交剪切反應為活細胞內的蛋白質安裝了功能開關。這一被稱為蛋白質“鄰近脫籠”(CAGE-Prox)的策略具有很強的普適性,實現了活細胞內各種酶家族蛋白質的瞬時激活(Nature. 2019, 569, 5095)。
最新的“脫籠”策略有哪些改進?
在《細胞》發表的工作中,作者結合逆電子需求Diels-Alder反應(IEDDA),將其應用于反式環辛烯-酪氨酸(TCOY)的保護和脫保護,并通過蛋白語言模型訓練機器學習算法,捕捉序列特征與蛋白質功能之間的相關性,輔以Rosetta軟件對接模擬酶和底物的相互作用,從而提高了tRNA合成酶(PylRS)變體選擇的成功率,最終實現了TCOY的識別和編碼表達。
這一“化學開關”的引入,能夠暫時關閉目標蛋白質的功能,并可通過小分子誘導的生物正交剪切反應在體內原位恢復,實現可控激活,獲得了適用于活體動物的通用蛋白質激活策略(CAGE-Proxvivo)。
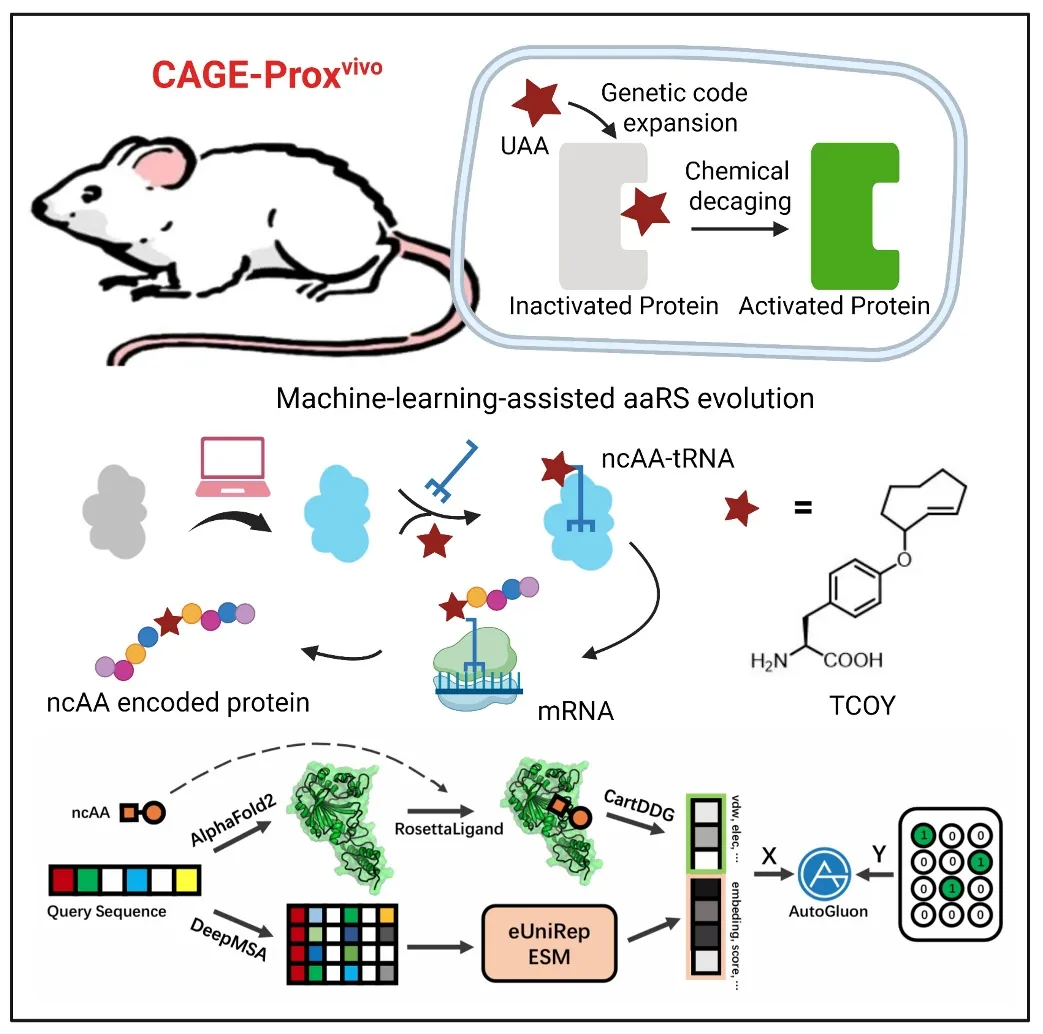
機器學習驅動的蛋白質活體激活策略:通過蛋白語言模型訓練機器學習算法,設計和篩選tRNA合成酶(PylRS)變體,實現了可化學脫籠的反式環辛烯-酪氨酸(TCOY)的識別和編碼表達,用于后續在體蛋白質功能激活和互作調控
新的“脫籠”策略能做啥?
在建立CAGE-Proxvivo標準流程后,作者將其應用于蛋白質靶向遞送與激活治療。作者巧妙地設計了靶向遞送與化學激活的雙重控制,構建了“蛋白質前藥”系統,利用靶向遞送,實現了炭疽致死因子(Lethal factor)的可控、原位激活,有效抑制了實體腫瘤的生長。
在此基礎上,作者通過CAGE-Proxvivo策略成功實現了細胞焦亡(pyroptosis)在腫瘤內部的可控-特異誘導。細胞焦亡作為一種由Caspase介導的炎癥性細胞死亡方式,因其激活免疫應答的潛力而備受關注。盡管傳統化療藥物能誘導細胞焦亡,但鑒于GSDME在許多腫瘤細胞中的低表達,腫瘤特異性誘導焦亡仍面臨重要挑戰。CAGE-Proxvivo技術則在小鼠肺癌細胞中引發了Caspase-3依賴性GSDME切割,誘導細胞焦亡,觸發免疫殺傷,有效抑制了繼發腫瘤的生長。作者進一步擴大了該策略的應用范圍,在多種腫瘤細胞中展示了細胞焦亡介導的免疫治療潛力。
此外,作者通過改進計算建模流程,將“化學開關”從酶活口袋拓展至蛋白質到互作界面,實現了蛋白–蛋白相互作用的精確調控,并開發了生物正交“門控”雙特異性抗體,用于腫瘤免疫治療。在該應用中,作者通過遺傳編碼將TCOY引入抗CD3抗體(aCD3),并將其與腫瘤靶向模塊結合,構建了具有條件性激活能力的“開關”型T細胞接合器(T cell engager, TCE)。隨后通過活體生物正交剪切技術恢復T細胞活性,精確激活腫瘤部位的T細胞,有效避免了系統性細胞因子釋放綜合征(CRS)及其引發的毒性反應,提高了治療安全性,為在實體瘤的免疫治療中,將免疫原性低的“冷”腫瘤轉變為高免疫原性的“熱”腫瘤提供了新的途徑。
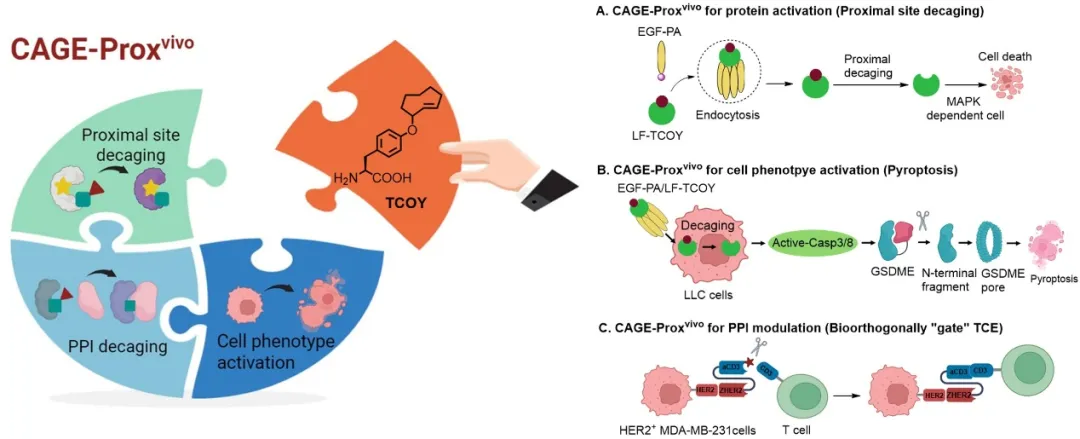
CAGE-Proxvivo蛋白質活體原位激活通用平臺應用:在活體動物中按需激活蛋白質功能;調節細胞表型,誘導腫瘤細胞發生焦亡,增強抗腫瘤免疫反應;精確調節蛋白質-蛋白質相互作用,實現生物正交“門控”雙特異性抗體,用于按需招募和激活T細胞
除TCOY外,作者基于統一的機器學習模型成功進化出可識別反式環辛烯-半胱氨酸(TCOC)的PylRS變體,并通過CAGE-Proxvivo策略實現了半胱氨酸的可控化學遮蔽以及活體內蛋白功能的精準調控。該研究進一步展示了結合蛋白質語言模型與結構建模特征的混合策略在底物譜拓展中的有效性和普適性,有望實現更多天然氨基酸的遮蔽-脫籠,為活體內生物大分子功能和生命過程的精準操控建立通用平臺。
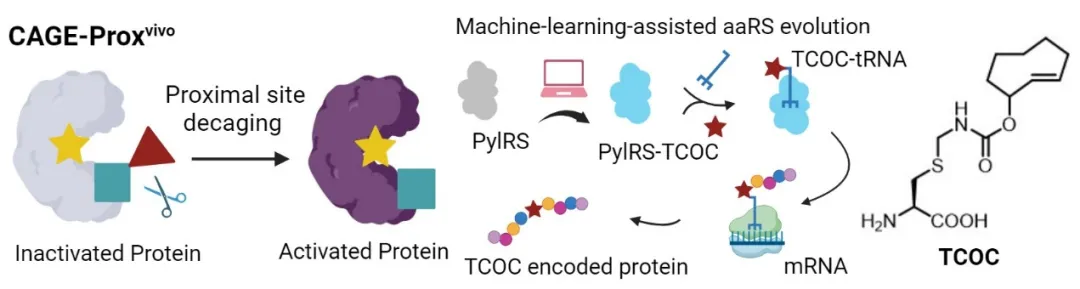
機器學習模型成功進化出可識別反式環辛烯-半胱氨酸(TCOC)的PylRS變體,并通過CAGE-Proxvivo策略實現了半胱氨酸的可控化學遮蔽以及活體內蛋白功能的精準調控
陳鵬、王初為本文的共同通訊作者。北京大學前沿交叉學科研究院已畢業博士研究生汪欣(現深圳灣實驗室博士后)、北京大學化學與分子工程學院副研究員劉源為本文的共同第一作者。
本工作獲得科技部、國家自然科學基金委、北京分子科學國家研究中心、新基石基金會和北京大學AI4S等項目的支持。
① 凡本站注明“稿件來源:教育在線”的所有文字、圖片和音視頻稿件,版權均屬本網所有,任何媒體、網站或個人未經本網協議授權不得轉載、鏈接、轉貼或以其他方式復制發表。已經本站協議授權的媒體、網站,在下載使用時必須注明“稿件來源:教育在線”,違者本站將依法追究責任。
② 本站注明稿件來源為其他媒體的文/圖等稿件均為轉載稿,本站轉載出于非商業性的教育和科研之目的,并不意味著贊同其觀點或證實其內容的真實性。如轉載稿涉及版權等問題,請作者在兩周內速來電或來函聯系。





 教育在線
教育在線



