近日,杭州師范大學基礎醫學院郭瑞庭教授團隊聯合中國科學院天津工業生物技術研究所高書山研究員團隊,采用單顆粒冷凍電鏡技術在麥角生物堿生物合成關鍵酶EasC研究上取得新突破。該研究相關成果以“Chanoclavine synthase operates by an NADPH independent superoxide mechanism"為題3月6日在國際頂級期刊Nature(《自然》)上在線發表。
郭瑞庭教授與高書山研究員為論文的共同通訊作者。杭州師范大學為論文的第一單位,中科院微生物所、湖北大學、荷蘭代爾夫特理工大學、中國科學技術大學、中國海洋大學為論文合作單位。這是學校首篇作為第一完成單位在Nature上發表的論文,實現了重大突破。
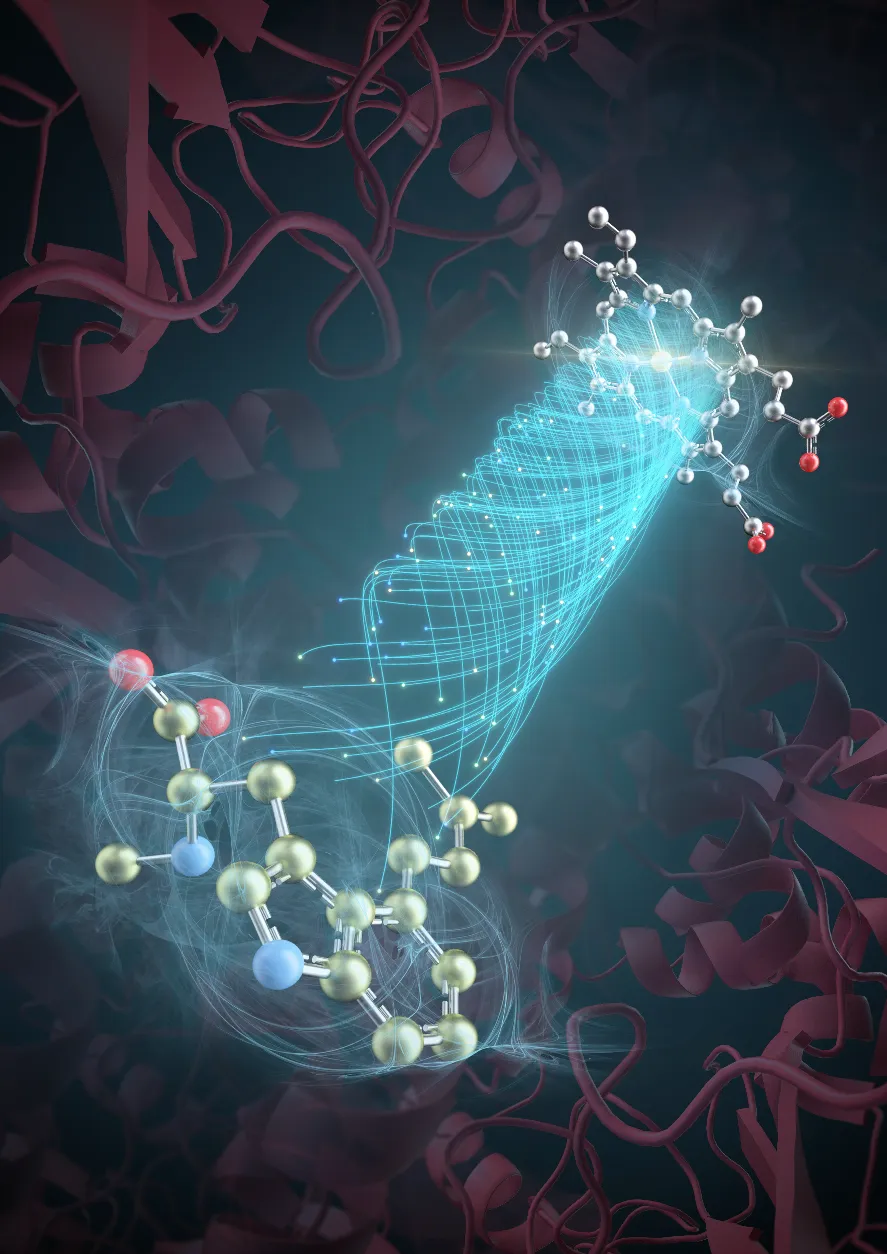
近年來,麥角生物堿類化合物的微生物合成體系構建與優化成為各國科學家研究的焦點。研究表明,過氧化氫酶EasC是麥角生物堿生物合成關鍵酶。但由于麥角生物堿生物合成關鍵酶EasC的結構信息缺失,造成底物結合模式與酶催化機制長期以來處于黑箱之中,科學家們無法得知真正的催化機制,更無法進一步進行酶的改造。
郭瑞庭教授團隊與高書山研究員團隊合作,就這一懸而未決的科學問題開展了研究。郭瑞庭教授團隊利用單顆粒冷凍電鏡解析了麥角生物堿合成酶EasC與底物的單顆粒冷凍電鏡結構,發現麥角生物堿底物結合區獨立于血紅素結合區之外,單獨存在于另一個區域中,完全顛覆了以往已知類型由血紅素和底物直接結合并催化的酶反應機制。
研究團隊結合生物化學、同位素化學以及波譜學實驗,發現了一種全新的、不依賴輔酶-氧的非典型氧氣激活途徑。該途徑產生的超氧陰離子可以進一步通過超氧陰離子傳遞通道輸送至麥角生物堿底物反應位點,催化一連串復雜的環化反應以生成麥角生物堿。
據研究團隊介紹,在以往的研究中,不同模式的氧氣激活途徑及其生物合成參與機制鮮見報道。學術界廣泛采用的典型氧氣激活途徑為酶結構中的有機分子或金屬離子等輔酶與氧氣結合,形成輔酶-氧激活復合體;輔酶-氧激活復合體進一步來催化底物的氧化/加氧等生物化學反應。
本研究展示了一種全新的氧氣激活途徑,即將氧氣轉化為超氧陰離子的非典型機制;該氧氣激活途徑通過產生超氧陰離子,而非典型激活途徑的輔酶-氧復合物,參與微生物藥物的生物合成,拓展了關于氧氣參與微生物合成代謝的機制和作用的研究,為深入理解微生物在不同環境條件下的代謝過程提供了新的視角和理論基礎。同時,本研究也讓過氧化氫酶的相關研究從H2O2依賴性酶轉向O2依賴性酶,拓展了過氧化氫酶這一氧化酶的研究領域。
“該研究成果不僅是基礎醫學院堅持有組織科研,打破界限、協同創新取得的成果,也為學校推進‘雙一流’建設注入了強大動力,為地方經濟社會發展提供了有力支撐。”學校科研處負責人李勇進教授表示,將不斷加大支持力度,為科研人員坐住坐穩“冷板凳”、敢于善于“攀頂峰”做好服務,推動形成更多“能上書架”“擺上貨架”的重大原始創新成果。
近年來,學校緊密圍繞市委市政府《關于進一步支持杭州師范大學爭創國家“雙一流”建設高校的若干意見》,聚焦“頂天”“立地”,對標“六個一流”,統籌推進教育科技人才一體化發展。通過實施“登峰工程”,開展有組織科研,推進以教育學、分子手性與生物醫藥交叉學科為重點的學科群建設,推動不同學科間的深度交叉融合,為重大原始創新成果的產生提供土壤,并設立“交叉學科團隊建設工程”專項資金,鼓勵學科交叉融合與標志性成果產出。
① 凡本站注明“稿件來源:中國教育在線”的所有文字、圖片和音視頻稿件,版權均屬本網所有,任何媒體、網站或個人未經本網協議授權不得轉載、鏈接、轉貼或以其他方式復制發表。已經本站協議授權的媒體、網站,在下載使用時必須注明“稿件來源:中國教育在線”,違者本站將依法追究責任。
② 本站注明稿件來源為其他媒體的文/圖等稿件均為轉載稿,本站轉載出于非商業性的教育和科研之目的,并不意味著贊同其觀點或證實其內容的真實性。如轉載稿涉及版權等問題,請作者在兩周內速來電或來函聯系。





 中國教育在線
中國教育在線




